 |
 | |
 | |
 | |
| الأسماء | |
|---|---|
| اسم أيوپاك
نترات الأمونيوم
| |
| تمييز | |
| رقم RTECS | BR9050000 |
| SMILES | |
| InChI | InChI=1/NO3.H3N/c2-1(3)4;/h;1H3/q-1;/p+1 |
| الخصائص | |
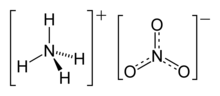
| الصيغة الجزيئية | (NH4)(NO3) |
| كتلة مولية | 80.052 g/mol |
| المظهر | white/grey solid |
| الكثافة | 1.725 g/cm3 (20 °C) |
| نقطة الانصهار |
169.6 °C
|
| نقطة الغليان | |
| قابلية الذوبان في الماء | 118 g/100 ml (0 °C) 150 g/100 ml (20 °C) 297 g/100 ml (40 °C) 410 g/100 ml (60 °C) 576 g/100 ml (80 °C) 1024 g/100 ml (100 °C) |
| البنية | |
| البنية البلورية | trigonal |
| بيانات متفجر | |
| حساسية الصدم | منخفض جداً |
| حساسية الاحتكاك | منخفض جداً |
| سرعة الانفجار | 5270 m/s |
| المخاطر | |
| خطر رئيسي | Explosive |
| الجرعة أو التركيز القاتل (LD, LC): | |
LD50 (الجرعة الوسطى)
| 2085–5300 ملگ/كگ (عن طريق الفم في الفئرات والجرذان) |
| مركبات ذا علاقة | |
أنيونات أخرى
| نترات الأمونيوم |
كاتيونات أخرى
| نترات الصوديوم نترات البوتاسيوم Hydroxylammonium nitrate |
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa).
| |
كسماد
في المتفجرات
كان التطور التالي في الأهمية بعد الديناميت والمتفجر الهلامي، حلول نترات الأمونيوم محل جزء من النتروگلسرين للحصول على منتج أكثر أماناً وأقل كلفة. وكان استخدام نترات الأمونيوم في صنع المتفجرات قد سجل عام 1867 من قبل كيميائيين آخرين في السويد، غير أن نوبل هو من صنع «ضروب الديناميت الممتاز» extra dynamites بإنتاج مزيج هلامي يحتوي على 20-60% نترات الأمونيوم.وسعى كثيرون في الفترة بين عامي 1867 و1884 إلى تطوير مزيج نترات الأمونيوم الهلامي من دون نتائج مجدية؛ بسبب ميله لامتصاص الرطوبة غالباً. وفي عام 1885 توصل كيميائي أمريكي يدعى بنيمان R.S.Penniman إلى حل للمشكلة بتغليف نترات الأمونيوم بقليل من البارافين أو مادة مشابهة قبل استخدامه. وسرعان ما ظهرت بفضل هذا التطور أصناف عدة من ديناميت الأمونيا وشاع استخدامها. وبطل التغليف بعد أن تم التوصل إلى وسائل أكثر أماناً للتعامل مع مشكلة الرطوبة. وكل البلاد التي تستخرج الفحم من مناجم تحت الأرض تستخدم متفجرات من هذا النوع وفق ضوابط متفق عليها وتحت أسماء مختلفة. وتتصف هذه المتفجرات بضآلة كمية الحرارة التي تنشرها عند الانفجار، واحتواء معظمها على عامل تبريد مثل كلوريد الصوديوم (ملح الطعام) أو كلوريد الأمونيوم لمنع حرارة الانفجار من إشعال الغازات الموجودة تحت الأرض وغبار الفحم.
ونترات الأمونيوم مادة كيماوية مؤكسدة شديدة مما يسهل تنفيذ التفجيرات بواسطتها، إذ يمكن تفجيرها لدى تسخينها بشدة، او تحويلها إلى متفجرات شديدة في حالة استخدامها مع الوقود القابل للاحتراق، أو لدى وضعها مع المتفجرات الاخرى التي يراد زيادة قوتها التفجيرية. وتستخدم هذه المادة في المناجم، كما يستعملها مختلف جيوش العالم. ووفقا للتصنيفات المعتمدة من قبل ادارات الدفاع المدني، فان نترات الأمونيوم يمكن ادراجها ضمن المتفجرات التي تقترب من صنوف المتفجرات السريعة التي تتراوح السرعة الانفجارية لها بين 3000 وأكثر من 8500 متر في الثانية. والسرعة الانفجارية هي السرعة التي تنتقل بها موجة الانفجار داخل جزيئات المادة. وتقع السرعة الانفجارية لنترات الأمونيوم بين 2500 و2700م في الثانية، وللمقارنة تبلغ السرعة الانفجارية لمادة «تي. أن. تي» الشديدة الانفجار 6900 م/ثانية، بينما تتراوح بالنسبة للنتروجليسرين بين 7500 و8000 م/ثانية.
السلامة، التداول والتخزين
مركب نترات الأمونيوم مسبب للحرائق، لذا يجب أخذ الحيطة والحذر عند التعامل معه عند تخزينه أو نقله. ويذكر التاريخ العديد من الحوادث بسببه، على سبيل المثال عام 1947 في ميناء تكساس.
التحضير
يحضر مركب نترات الأمونيوم من تمرير غاز الأمونياك في حمض الآزوت (تركيز 42%)، مع العلم أن تفاعل التحضير هذا ناشر للحرارة.
التفاعلات
Ammonium nitrate reacts with metal hydroxides, releasing ammonia and forming alkali metal nitrate:
- NH4NO3 + NaOH → NH3 + H2O + NaNO3
- NH4NO3 + KOH → NH3 + H2O + KNO3
Ammonium nitrate gives ammonium chloride and nitric acid upon reaction with hydrochloric acid:
- NH4NO3 + HCl → NH4Cl + HNO3
Ammonium nitrate leaves no residue when heated:
- NH4NO3 Δ→ N2O + 2H2O
Ammonium nitrate is also formed in the atmosphere from emissions of NO, SO2 and NH3 and is a secondary component of PM10.
المراحل البلورية
التحولات للمراحل البلورية يحدث نتيجة تغير الظروف (درجة الحرارة، الضغط) المؤثرة على الخصائص الفيزيائية لنترات الأمونيوم. تم التعرف على الحالات البلورية التالية:
| النظام | درجة الحرارة (°س) | الحالة | تغير الحجم (%) |
|---|---|---|---|
| - | > 169.6 | سائل | - |
| I | 169.6 إلى 125.2 | مكعب | +2.1 |
| II | 125.2 إلى 84.2 | tetragonal | −1.3 |
| III | 84.2 إلى 32.3 | α-rhombic | +3.6 |
| IV | 32.3 إلى −16.8 | β-rhombic | −2.9 |
| V | −16.8 | tetragonal | - |
المخاطر الصحية
الآثار الصحية الحادة
التعرض لفترات قصيرة لنترات الأمونيوم قد يتسبب في أعراض تتراوح بين التهيج البسيط إلى الغثيان، القيء، اضطراب الهضم، الصداع، الدوار وارتفاع ضغط الدم.
| أخفمنطقة التعرض | مستوى الخطر |
|---|---|
| الطعام الداخل للمعدة | خطر متوسط |
| لمس الجلد | خطر متوسط (تهيج) |
| لمس العين | خطر متوسط |
| الاستنشاق | خطر متوسط |
التأثيرات على المدى الطويل
| أخفأنواع التأثير | مستوى التأثير |
|---|---|
| تأثيرات مسرطنة | Though no ammonium-nitrate-specific studies are available, nitrates can be reduced to nitrites in the body, and the formed nitrites can subsequently react with amines to form suspect carcinogens N-nitrosamine. |
| Mutagenic effects | In general, nitrates and nitrites are genotoxic. |
| Teratogenic effects | None |
| Developmental toxicity | Though not specific to ammonium nitrate, some studies have shown a link between birth defects (particularly neural tube defects) and nitrate-contaminated well water. |
| Prolonged exposure | Causes damage to lungs and mucous membranes and may also cause damage to blood and gastrointestinal tract. Chronic ingestion may also cause nephritis. |





0 تعليقات